Una sinapsi è una giunzione specializzata nella quale un terminale assonico prende contatto con un altro neurone o qualche altro tipo di cellula. Normalmente la direzione del flusso di informazioni procede dal terminale assonico al neurone bersaglio, dunque il terminale assonico è detto pre-sinaptico e il neurone bersaglio è denominato post-sinaptico.
I diversi tipi di sinapsi
Le sinapsi elettriche
Consentono il diretto trasferimento della corrente ionica da una cellula alla successiva. Si rinvengono in siti specializzati chiamati giunzioni comunicanti. In una giunzione comunicante le membrane pre- e post-sinaptiche sono separate da uno spazio di soli 3 ηm, attraversato da speciali proteine denominate connessoni. I connessoni formano canali che permettono agli ioni di passare direttamente dal citoplasma di una cellula al citoplasma di un’altra.
La trasmissione nervosa attraverso le sinapsi elettriche è molto veloce e sicura. Di conseguenza un potenziale d’azione nel neurone pre-sinaptico, può generare, in modo quasi istantaneo, un potenziale d’azione nel neurone post-sinaptico.
Le giunzioni comunicanti appaiono molto comuni all’interno di una grande varietà di cellule non nervose, incluse le glia, le cellule epiteliali, le cellule dei muscoli lisci e di quello cardiaco ed alcune cellule ghiandolari. Esse si ritrovano frequentemente anche nei neuroni agli stadi embrionali precoci. Esse, infatti, permettono alle cellule vicine di condividere segnali sia elettrici che chimici, i quali possono aiutarle a coordinare la loro crescita e maturazione.
Le sinapsi chimiche
La trasmissione sinaptica del sistema nervoso umano maturo è di tipo chimico.
Le membrane pre- e post-sinaptiche di una sinapsi chimica sono separate da uno spazio chiamato fessura sinaptica o spazio intersinaptico, dieci volte più grande rispetto a quello presente tra le giunzioni comunicanti. La fessura è riempita con proteine fibrose che fanno aderire le due membrane l’una all’altra.
La terminazione presenta una dozzina sferette invaginate nella membrana, chiamate vescicole sinaptiche, che contengono il neurotrasmettitore, ossia l’insieme di molecole utilizzate per comunicare con il neurone successivo.
Molti terminali assonici contengono anche vescicole di dimensioni maggiori denominate granuli escretori e contenenti proteine solubili.
Nelle membrane di entrambe le facce della fessura sinaptica si osservano numerosi accumuli di proteine che, nel loro insieme, sono chiamate specializzazioni di membrana.
Nel versante pre-sinaptico le proteine che si proiettano entro il citoplasma del terminale assonico, insieme alla membrana stessa, rappresentano gli effettivi siti di rilascio del neurotrasmettitore e costituiscono le cosiddette zone attive.
La struttura proteica che attraversa la zona densa della membrana post-sinaptica è detta densità post-sinaptica (DPS). La DPS contiene i ricettori per il neurotrasmettitore, i quali convertono il segnale chimico intercellulare in segnale intracellulare, nella cellula post-sinaptica.
Nel SNC possono essere distinti differenti tipi di sinapsi a seconda della zona del neurone che costituisce l’elemento post-sinaptico:
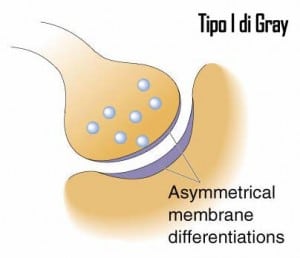
Le sinapsi in cui le specializzazioni di membrana hanno uno spessore simile sono dette simmetriche o sinapsi del II tipo di Gray e sono generalmente di tipo inibitorio. Le sinapsi invece in cui le specializzazioni di membrana sul lato post-sinaptico sono più dense che sul lato pre-sinaptico sono dette asimmetriche o sinapsi del I tipo di Gray e tendenzialmente sono di tipo eccitatorio.
Le giunzioni sinaptiche che si trovano tra gli assoni dei motoneuroni del midollo spinale e dei muscoli scheletrici sono chiamate giunzioni neuromuscolari. Normalmente un potenziale d’azione nell’assone di un motoneurone induce sempre un potenziale d’azione nella cellula muscolare che innerva. La trasmissione sinaptica è veloce ed affidabile. Tale affidabilità è dovuta in buona parte alle specializzazioni strutturali delle giunzioni pre- e post-sinaptiche. La terminazione pre-sinaptica contiene infatti un gran numero di zone attive; mentre quella post-sinaptica, chiamata anche placca motrice, contiene una serie di piccole pieghe, dove si raccolgono i recettori per i neurotrasmettitori, perfettamente allineate con le zone attive. In questo modo, garantiscono che una grande quantità di molecole di neurotrasmettitore sia rilasciata su una superficie provvista di chemiocettori.
I neurotrasmettitori
I neurotrasmettitori rientrano in 3 categorie chimiche:
1) aminoacidi
2) amine
3) peptidi
i neurotrasmettitori aminoacidi e aminici sono piccole molecole organiche, contenenti un atomo di azoto, che vengono incorporate e poi rilasciate dalle vescicole sinaptiche.
I neurotrasmettitori peptidici, invece, sono grandi molecole incorporate, rilasciate dai granuli secretori.
Nel cervello, neuroni differenti rilasciano neurotrasmettitori differenti.
La trasmissione sinaptica veloce, nella maggior parte delle sinapsi del SNC, è mediata dagli aminoacidi glutammato (Glu) e GABA. L’amina acetilcolina (ACh) media la trasmissione sinaptica veloce nelle giunzioni neuromuscolari.
Forme più lente di trasmissione sinaptica nel SNC e in periferia sono mediate da tutti e tre i tipi di trasmettitori.
Sintesi e immagazzinamento del neurotrasmettitore
 La trasmissione sinaptica di tipo chimico richiede che il neurotrasmettitore sia sintetizzato e pronto per essere rilasciato. Differenti neurotrasmettitori vengono sintetizzati in modo diverso. Il glutammato, per esempio, essendo uno dei venti aminoacidi, si trova in abbondanza in tutte le cellule del corpo, neuroni inclusi; mentre il GABA e le amine sono prodotti esclusivamente dai neuroni che le rilasciano. Gli enzimi sintetizzatori vengono trasportati nel terminale assonico, dove dirigono rapidamente la sintesi del neurotrasmettitore.
La trasmissione sinaptica di tipo chimico richiede che il neurotrasmettitore sia sintetizzato e pronto per essere rilasciato. Differenti neurotrasmettitori vengono sintetizzati in modo diverso. Il glutammato, per esempio, essendo uno dei venti aminoacidi, si trova in abbondanza in tutte le cellule del corpo, neuroni inclusi; mentre il GABA e le amine sono prodotti esclusivamente dai neuroni che le rilasciano. Gli enzimi sintetizzatori vengono trasportati nel terminale assonico, dove dirigono rapidamente la sintesi del neurotrasmettitore.
Una volta sintetizzati nel citosol, i neurotrasmettitori aminici e aminoacidici, attraverso delle speciali proteine che si trovano nella membrana delle vescicole (le proteine trasportatori), vengono concentrati all’interno delle vescicole stesse.
Rilascio del neurotrasmettitore
Il rilascio del neurotrasmettitore è attivato dall’arrivo al terminale assonico di un potenziale d’azione. La depolarizzazione della membrana a questo livello induce l’apertura dei canali per il calcio voltaggio dipendenti nelle zone attive. L’innalzamento della concentrazione interna degli ioni calcio che ne deriva è il segnale che causa il rilascio del neurotrasmettitore da parte delle vescicole sinaptiche.
Le vescicole liberano i loro contenuti attraverso un processo denominato esocitosi. La membrana della vescicola sinaptica si fonde con la membrana pre-sinaptica nella zona attiva, permettendo ai contenuti della vescicola di riversarsi entro lo spazio sinaptico.
La membrana della vescicola viene successivamente recuperata attraverso un processo di endocitosi, per essere nuovamente riempita di neurotrasmettitore.
Anche i granuli secretori rilasciano neurotrasmettitori peptidici per esocitosi, attraverso una modalità calcio-dipendente, ma solitamente non nelle zone attive. Poiché i siti di esocitosi si trovano ad una certa distanza dai canali di entrata del calcio, il rilascio di peptidi avviene solo in caso di numerosi potenziali d’azione ad alta frequenza. La liberazione dei peptidi è un processo più lento: 50 msec rispetto a 2 msec delle vescicole sinaptiche.
I recettori dei neurotrasmettitori e gli effettori
I neurotrasmettitori liberati dalla fessura sinaptica influenzano il neurone post-sinaptico legandosi a centinaia di specifiche proteine recettrici incastonate nell’ispessimento post-sinaptico. Il legame di un neurotrasmettitore per il recettore è come l’inserimento di una chiave in una serratura, questo causa cambiamenti nella conformazione della proteina.
I recettori dei neurotrasmettitori possono essere divisi in due categorie:
1) i canali ionici trasmettitore-dipendenti
2) i recettori accoppiati alla proteina G
I canali ionici trasmettitore-dipendenti
sono proteine che attraversano la membrana, costituiti di 5 unità che si uniscono formando un poro. In assenza di neurotrasmettitore il poro è chiuso. Quando il neurotrasmettitore si lega a specifici siti sulla regione extracellulare del canale, questo induce un cambiamento configurazionale che provoca l’apertura del poro.
FOCUS
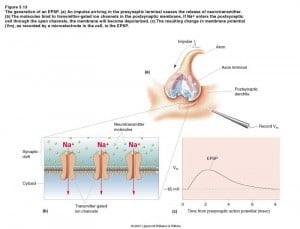
- Un impulso arriva al terminale pre-sinaptico, inducendo il rilascio del neurotrasmettitore.
- Le molecole si legano ai canali ionici trasmettitore-dipendenti nella membrana post-sinaptica
- Se gli ioni Na+ entrano nella cellula post-sinaptica, attraverso i canali aperti, questa si depolarizza.
- Il cambiamento risultante nel potenziale di membrana viene chiamato potenziale post-sinaptico eccitatorio (PPSE)
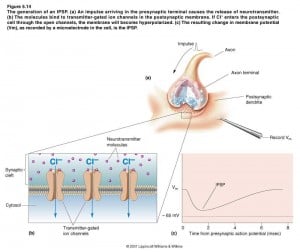
Se i canali trasmettitore-dipendenti sono permeabili al cloro Cl-, si verificherà un’iperpolarizzazione della cellula rispetto al potenziale di membrana a riposo.
Poiché ciò tende a portare il potenziale di membrana lontano dal valore di soglia per la generazione dei potenziali d’azione, questo effetto è detto inibitorio.
Dunque, un’iperpolarizzazione del potenziale di membrana post-sinaptico causato dal rilascio di un neurotrasmettitore è detto potenziale post-sinaptico inibitorio (PPSI).
L’attivazione sinaptica dei canali ionici GABA-dipendenti produce un PPSI.
L’attivazione sinaptica dei canali ionici ACh-dipendenti e Glutammato-dipendenti induce i PPSE.
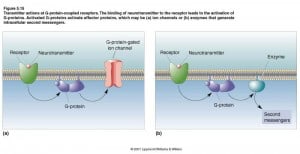
I recettori accoppiati alla proteina G
Tutti e tre i tipi di neurotrasmettori agenti sui recettori accoppiati alle proteine G svolgono azioni post-sinaptiche seguendo queste tre fasi:
1) Le molecole del neurotrasmettitore si legano alle proteine recettrici incastonate nella membrana post-sinaptica.
2) Le proteine recettrici attivano piccole molecole proteiche, chiamate proteine G, che sono libere di muoversi lungo la faccia intracellulare della membrana post-sinaptica.
3) Le proteine G una volta attivate, attivano a loro volta proteine effettori che possono essere canali ionici o enzimi che sintetizzano molecole chiamate secondi messaggeri, le quali si diffondono nel citosol.
4) I secondi messaggeri possono attivare nel citosol enzimi supplementari in grado di regolare la funzione di canali ionici e alterare il metabolismo cellulare. Poiché i recettori accoppiati alle proteine G possono innescare un gran numero di processi metabolici, vengono detti recettori metabotropici.
Gli autorecettori
I recettori dei neurotrasmettitori si trovano anche nella mebrana del terminale assonico pre-sinaptico. I recettori che sono sensibili al neurotrasmettitore rilasciato dalla terminazione pre-sinaptica sono chiamati autorecettori. Solitamente sono accoppiati alle proteine G e promuovono la formazione del secondo messaggero. Svolgono anche la funzione di “valvole di sicurezza”, per ridurre la liberazione di neurotrasmettitore quando la concentrazione di quest’ultimo nella fessura sinaptica raggiunge valori troppo elevati.
Recupero e degradazione del neurotrasmettitore
Una volta che il neurotrasmettitore è stato liberato ed ha interagito con i recettori post-sinaptici, deve essere eliminato dalla fessura sinaptica per permettere una successiva trasmissione sinaptica. questo processo può avvenire in più modi:
- per semplice diffusione delle molecole del trasmettitore fuori dalla sinapsi,
- tramite un riassorbimento condotto da specifiche proteine che si trovano nella membrana pre-sinaptica,
- tramite il riassorbimento operato dalle proteine presenti nelle membrane della glia,
- attraverso la distruzione enzimatica all’interno della stessa fessura sinaptica.
Una volta giunti nel citosol del terminale assonico, i neurotrasmettitori possono venire distrutti per via enzimatica o essere riassunti dalle vescicole sinaptiche.
Alcuni farmaci, chiamati inibitori, riescono a bloccare il normale funzionamento di proteine specifiche coinvolte nella trasmissione sinaptica. Gli inibitori dei recettori per il neurotrasmettitore, denominati recettori antagonisti, si legano al recettore e bloccano l’azione del trasmettitore (es. il curaro).
Esistono altri farmaci che si legano ai recettori, ma anziché inibirli simulano l’azione dei neurotrasmettitori normalmente presenti. Essi sono chiamati recettori agonisti (es. la nicotina).
L’integrazione dei potenziali sinaptici eccitatori ( PPSE )
La membrana post-sinaptica contiene migliaia di canali trasmettitore-dipendenti; il numero di canali attivati durante la trasmissione sinaptica dipende dalla quantità di neurotrasmettitore che viene liberato.
L’unità elementare di neurotrasmettitore rilasciato equivale al contenuto di una singola vescicola sinaptica.
La sommazione di PPSE
rappresenta la forma più semplice di integrazione sinaptica del SNC. Esistono due tipi di sommazione : spaziale e temporale.
La sommazione spaziale
si ha quando vengono sommati insieme i PPSE generati simultaneamente da molte sinapsi diverse su un unico dendrite.
La sommazione temporale
si ha quando vengono sommati insieme i PPSE generati in rapida successione dalla stessa sinapsi.
Il contributo delle proprietà del dendrite all’integrazione sinaptica
La corrente entrante nei siti di contatto sinaptico deve diffondersi nel dendrite, attraversare il corpo cellulare e provocare la depolarizzazione della membrana oltre la soglia, prima che un potenziale d’azione possa essere generato.
L’efficacia di una sinapsi eccitatoria nel produrre un potenziale d’azione dipende dunque da quanto le sinapsi sono lontane dalla zona d’innesco e dalla proprietà della membrana dendritica.
La propagazione di un potenziale d’azione dipenderà:
1) dalla resistenza interna, ossia la resistenza alla corrente che scorre longitudinalmente lungo il dendrite che dipende dal diametro del dendrite e dalle proprietà elettriche del citoplasma,
2) dalla resistenza di membrana, ossia la resistenza alla corrente che attraversa la membrana che dipende dal numero di canali ionici aperti.
I dendriti possono essere dotati di membrane sia passive che eccitabili. Esiste una classe di neuroni con dendriti dotati di un significativo numero di canali per il sodio e/o per il calcio voltaggio dipendenti. Il numero di questi canali dendritici non è sufficiente per generare potenziali d’azione in grado di propagarsi senza decremento, come avviene negli assoni. I canali voltaggio-dipendenti dei dendriti possono, tuttavia, comportarsi come considerevoli amplificatori di piccoli potenziali post-sinaptici generati in zone periferiche del dendrite.
I PPSE finirebbero quasi per annullarsi, ma se il dendrite passivo è abbastanza grande, esso può provocare l’apertura dei canali sodio voltaggio-dipendenti che, a loro volta, aggiungerebbero corrente per incrementare il segnale sinaptico che si propaga verso il corpo cellulare.
L’inibizione
Non tutte le sinapsi del cervello sono di tipo eccitatorio. Infatti, l’azione di alcune sinapsi allontana il potenziale di membrana dal valore di soglia del potenziale d’azione. Queste sinapsi sono chiamate sinapsi inibitorie. Le sinapsi inibitorie esercitano un potente controllo sulla risposta di un neurone.
I PPSI e l’inibizione per derivazione
i recettori post-sinaptici della maggior parte delle sinapsi inibitorie sono simili a quelle delle sinapsi eccitatorie: si tratta di canali trasmettitore-dipendenti. Le uniche differenze consistono nel fatto che essi legano neurotrasmettitori diversi e consentono a ioni differenti il passaggio attraverso i loro canali. I canali trasmettitore-dipendenti di molte sinapsi inibitorie sono permeabili soltanto allo ione cloro (Cl-). L’apertura dei canali cloro, permette agli ioni Cl- di attraversare la membrana in una direzione, in modo da portare il potenziale di membrana verso il potenziale di equilibrio del cloro, ossia –65mV.
Anche qualora non esista alcun PPSI manifesto, il neurone è ugualmente inibito. Questo si verifica grazie all’inibizione per derivazione. Il principio fisico dell’inibizione per derivazione consiste nell’afflusso di ioni cloro con carica negativa, il che equivale formalmente a un flusso di corrente positiva uscente.
L’azione di una sinapsi inibitoria contribuisce dunque all’integrazione sinaptica: i PPSI possono essere sottratti dai PPSE, facendo in modo che il neurone post-sinaptico inneschi meno facilmente i potenziali d’azione.
Le sinapsi inibitorie del cervello usano il GABA come neurotrasmettitore. Esse, oltre ad essere sui dendriti, sono presenti su molti neuroni nei loro corpi cellulari e vicino al cono d’emergenza assonico, dove godono di una posizione strategica per iniziare l’attività del neurone post-sinaptico.
La modulazione
La maggior parte dei meccanismi post-sinaptici coinvolge i recettori per il neurotrasmettitore, essi stessi canali ionici.
Esistono tuttavia molte sinapsi con recettori accoppiati alla proteina G che non sono direttamente associati a canali ionici. L’attivazione sinaptica di questi recettori non evoca direttamente i PPSE e i PPSI, ma modula invece l’efficacia dei PPSE generati da altre sinapsi che sono dotate di canali trasmettitore dipendenti.
Questo tipo di trasmissione sinaptica è chiamato modulazione.
IN BREVE
- supponiamo di calpestare una puntina da disegno
- il potenziale d’azione che è sorto nel nervo sensitivo calpestando la puntina, tramite l’assone, ha raggiunto il terminale assonico nel midollo spinale.
- Le depolarizzazione del terminale ha innescato l’ingresso pre-sinaptico di Ca2+ attraverso i canali per il calcio voltaggio-dipendenti, i quali hanno stimolato la liberazione dei contenuti delle vescicole pre-sinaptiche.
- Una volta liberato, il neurotrassmettitore si è legato ai recettori della membrana post-sinaptica.
- Il trasmettitore (glutammato) ha causato l’apertura dei canali trasmettitore dipendenti, che hanno consentito alla carica positiva di entrare nel dendrite post-sinaptico.
- Poiché il nervo sensitivo stava producendo potenziali d’azione ad alta frequenza e poiché numerose sinapsi venivano attivate contemporaneamente, i PPSE si sono sommati per raggiungere il valore di soglia, indispensabile affinché la cellula potesse produrre potenziali d’azione.
- Se la cellula fosse stata un motoneurone, questo processo avrebbe causato il rilascio di ACh nella giunzione neuromuscolare e provocato la contrazione del muscolo.